حياتياتي ڪيميا
حياتياتي ڪيميا (Biochemistry) جاندارن جي اندر لاڳاپيل ڪيميائي عملن جو مطالعو آهي. ڪيمسٽري ۽ حياتيات ٻنهي جو هڪ ذيلي نظم، بائيو ڪيمسٽري کي ٽن شعبن ۾ ورهائي سگهجي ٿو:
- ساختي حياتيات
- اينزائمولوجي ۽
- ميٽابولزم
20هين صديءَ جي آخري ڏهاڪن ۾، حياتياتي ڪيميا انهن ٽن مضمونن جي ذريعي زندگين جي عملن جي وضاحت ڪرڻ ۾ ڪامياب ٿي چڪي آهي. حياتياتي سائنس جي تقريبن سڀني شعبن کي بايو ڪيميڪل طريقي ۽ تحقيق ذريعي دريافت ڪيو ويو آهي ۽ ترقي ڪئي وئي آهي. بايو ڪيمسٽري ان ڪيميائي بنيادن کي سمجهڻ تي ڌيان ڏئي ٿي جيڪا حياتياتي سالمن (molecules) کي انهن عملن کي جنم ڏيڻ جي اجازت ڏئين ٿا جيڪي جاندار جيو گھرڙن (cells) جي وچ ۾ ٿين ٿا، ان جي نتيجي ۾ ٽشوز ۽ عضون جي سمجھڻ سان گڏوگڏ عضوي جي جوڙجڪ ۽ ڪم سان لاڳاپيل آهي. بايو ڪيمسٽري جو تعلق ماليڪيولر بايولوجي سان آهي، جيڪو حياتياتي رجحان جي ماليڪيولر ميکانيزم جو مطالعو آهي. بائيو ڪيمسٽري جو گهڻو حصو حياتياتي وڏي سالمن جي جوڙجڪ، افعال ۽ رابطي سان تعلق رکي ٿو جهڙوڪ ڪاربوهائيڊريٽ، نيوڪليڪ ايسڊ، لپيد (Lipids) ۽ پروٽين. اهي سيلز جي جوڙجڪ مهيا ڪن ٿا ۽ زندگيء سان لاڳاپيل ڪيترن ئي ڪمن کي انجام ڏين ٿا. جيو گھرڙن جي ڪيمسٽري به ننڍڙن ماليڪيولن ۽ آئنز جي رد عمل تي دارومدار رکي ٿي. اهي غير نامياتي ٿي سگهن ٿا (مثال طور، پاڻي ۽ ڌاتو جا آئن) يا نامياتي (مثال طور، امائينو تيزاب، جيڪي پروٽين کي گڏ ڪرڻ لاء استعمال ڪيا ويندا آهن). ڪيميائي رد عمل ذريعي پنهنجي ماحول مان توانائي حاصل ڪرڻ لاءِ جيو گھرڙن پاران استعمال ٿيندڙ ميکانيزم کي "ميٽابولزم" چئبو آهي. بايو ڪيمسٽري جا نتيجا بنيادي طور تي دوا، غذائيت ۽ زراعت ۾ لاڳو ڪيا ويا آهن. طب ۾ حياتياتي ماهرن بيمارين جي سببن ۽ علاج جي تحقيق ڪن ٿا. غذائيت جو مطالعو، صحت ۽ تندرستي کي ڪيئن برقرار رکڻ ۽ غذائيت جي گھٽتائي جا اثر ڇا آهن، جي متعلق آھي. زراعت ۾، بائيو ڪيمسٽ مٽي ۽ ڀاڻ جي تحقيق فصلن جي پوک کي بهتر ڪرڻ، فصل جي اسٽوريج ۽ آفتن جي ڪنٽرول جي مقصد سان ڪن ٿا. تازن ڏهاڪن ۾، بايوڪيميڪل اصولن ۽ طريقن کي بايوٽيڪنالاجي جي نظم، مسئلا حل ڪرڻ واري طريقن سان انجنيئرنگ کان وٺي زندگين جي نظام کي هٿي وٺرائڻ لاءِ تحقيق، صنعتي عملن ۽ مرض جي تشخيص ۽ ڪنٽرول لاءِ مفيد اوزار پيدا ڪرڻ لاءِ، گڏ ڪيو ويو آهي.
اصطلاح
[سنواريو]اصطلاح "بائيو ڪيمسٽري" پهريون ڀيرو ونزينز ڪليتزنسڪي (Vinzenz Kletzinsky) (1826-1882) استعمال ڪيو، جڏهن سال 1858ع ۾ هن جو "Compendium der Biochemie" ويانا ۾ ڇپيو؛ اهو حياتيات ۽ ڪيمسٽري جي ميلاپ مان نڪتل آهي.
سال 1877ع ۾، فيلڪس هوپ-سيلر اصطلاح (جرمن ۾ بايو ڪيمي) "Zeitschrift für Physiologische Chemie" (جرنل آف فزيولوجيڪل ڪيمسٽري) جي پهرين شماري ۾، فزيولوجيڪل ڪيمسٽري جي مترادف طور استعمال ڪيو، جتي هن مطالعي جي هن ميدان لاء وقف ڪيل ادارن جي قيام لاءِ دليل ڏنو.[1][2] جيتوڻيڪ اڪثر حوالو ڏنو ويو آهي ته اهو لفظ جرمن ڪيمسٽ، ڪارل نيوبرگ سال 1903ع ۾ ٺهرايو هو،[3][4][5] جڏهن ته ڪجهه ان کي فرانز هوفميسٽر ڏانهن ڪريڊٽ ڏنو آهي.[6]
تاريخ
[سنواريو]- اصل مضمون جي لاءِ ڏسو حياتياتي ڪيميا جي تاريخ

ان جي سڀ کان وڌيڪ جامع وصف تي، حياتياتي ڪيمسٽري کي جاندار شين جي اجزاء ۽ ساخت جي مطالعي جي طور تي ڏسي سگهجي ٿو ۽ ڪيئن اهي گڏ ٿين ٿا زندگي بڻجي. انهيءَ لحاظ کان، حياتياتي ڪيميا جي تاريخ انهيءَ ڪري تائين ٿي سگهي ٿي، جيترو قديم يوناني.[7] بهرحال، بائيو ڪيمسٽري هڪ مخصوص سائنسي نظم جي طور تي 19 صدي عيسويء ۾، يا ٿورو اڳ شروع ٿي، ان تي منحصر آهي ته بايو ڪيمسٽري جي ڪهڙي پهلو تي ڌيان ڏنو پيو وڃي. ڪن جو چوڻ هو ته بائيو ڪيمسٽري جي شروعات، سال 1833ع ۾ انسيلمي پين (Anselme Payen) طرفان پهرين اينزائم، ڊائسٽيس (هاڻي امائليس سڏيو وڃي ٿو) جي دريافت ٿي سگهي ٿي، [8] جڏهن ته ٻين سال 1897ع ۾ بايو ڪيمسٽري جو جنم ڪن ٿا، جڏهن ايڊورڊ بچنر (Eduard Buchner) هڪ پيچيده بايو ڪيميائي عمل، الڪوحل جي سيل کان آزاد نڪتل خمير کي، حياتياتي ڪيميا جو پهريون جنم سمجهيو. [9] [10] ڪجھ شايد ان جي شروعات جي طور تي 1842ع جي اثر واري ڪم ڏانھن اشارو ڪري سگھن ٿا، جڏهن جسٽس وون ليبيگ جيڪو ميٽابولزم جو ڪيميائي نظريو پيش ڪيو،[11] جي نامياتي ڪيميا جي فزيالوجي ۽ پيٽولوجي ۾ ايپليڪيشنن ۾، يا ان کان به اڳ 18 صدي عيسويء جي خمير ۽ تنفس تي انٿوني ليوائيزر پاران اڀياس کي حياتياتي ڪيميا جي شروعات سمجھڻ ٿا. [12] [13] فيلڊ ۾ ٻيا به ڪيترائي علمبردار جن بائيو ڪيمسٽري جي پيچيدگين جي پرتن کي پڌرو ڪرڻ ۾ مدد ڪئي، جنهن کي جديد بايو ڪيمسٽري جا باني قرار ڏنو ويو آهي. ايمل فشر، جنهن پروٽين جي ڪيميا جو اڀياس ڪيو[14] ۽ ايف. گولينڊ هاپڪنز، جن اينزائمز ۽ بايو ڪيمسٽري جي متحرڪ نوعيت جو اڀياس ڪيو، شروعاتي بايو ڪيميا دانن جا ٻه مثال پيش ڪن ٿا.[15]
اهو هڪ ڀيرو عام طور تي مڃيو ويندو هو ته زندگي ۽ ان جي مواد ۾ ڪجهه ضروري خصوصيت يا مادو آهي (اڪثر ڪري "اهم اصول" جي طور تي حوالو ڏنو ويو آهي) جيڪا ڪنهن به غير جاندار مادي کان مختلف آهي ۽ اهو سوچيو ويندو هو ته صرف جاندار زندگي جي شيون پيدا ڪري سگھن ٿا.[16] سال 1828ع ۾ فريڊرڪ ووهلر پوٽاشيم سائانيٽ ۽ امونيم سلفيٽ مان پنهنجي سرنديپائيٽس يوريا جي ٺهڻ تي هڪ مقالو شايع ڪيو. ڪن ان کي وائيٽلزم جي سڌي تباهي ۽ نامياتي ڪيميا جي قيام جي طور تي سمجهيو ويو. [17] [18] بهرحال، ووهلر سنٿيسز (Wöhler synthesis) تڪرار کي جنم ڏنو، جيئن ڪجهه هن جي هٿن ۾ وائيٽلزم (حياتي نظريو) جي موت کي رد ڪري ڇڏيو.[19] ان وقت کان وٺي، بائيو ڪيمسٽري، خاص طور تي 20هين صدي جي وچ کان وٺي، نئين ٽيڪنالاجي، جهڙوڪ ڪروميٽوگرافي، ايڪس-ري تفاوت، ٻٽي پولرائزيشن انٽرفيرو ميٽري، اين ايم آر اسپيڪٽروڪوپي، ريڊيو آئسوٽوپڪ ليبلنگ، اليڪٽران مائڪرواسڪوپي ۽ ماليڪيولر ڊائنامڪس سائموليشن جي ترقي سان ترقي ڪئي آهي. انهن ٽيڪنالاجي ڪيترن ئي ماليڪيولن ۽ جيو گھرڙن جي ميٽابولڪ رستن جي دريافت ۽ تفصيلي تجزيي جي اجازت ڏني، جهڙوڪ گلائڪوليسز ۽ ڪربس چڪر (سيٽرڪ ايسڊ چڪر) ۽ هڪ ماليڪيولر سطح تي بائيو ڪيمسٽري جي سمجھڻ جو سبب بڻيا.
بايو ڪيمسٽري ۾ هڪ ٻيو اهم تاريخي واقعو جين (Gene) جي دريافت ۽ جيو گھرڙن ۾ معلومات جي منتقلي ۾ ان جو ڪردار آهي. 1950ع واري ڏهاڪي ۾ جيمس ڊي واٽسسن، فرانسس ڪريڪ، روزلنڊ فرينڪلن ۽ موريس ولڪنز ڊي اين اي جي جوڙجڪ کي حل ڪرڻ ۽ معلومات جي جينياتي منتقلي سان ان جو تعلق تجويز ڪرڻ ۾ اهم ڪردار ادا ڪيو. [20] سال 1958ع ۾ جارج بيڊل ۽ ايڊورڊ ٽاٽم کي نوبل انعام مليو ته فنگس ۾ ڪم ڪري ڏيکاريو ويو ته هڪ جين هڪ اينزائم پيدا ڪري ٿو. [21] سال 1988ع ۾، ڪولن پچفورڪ پهريون شخص هو جنهن کي ڊي اين اي ثبوت سان قتل جي سزا ڏني وئي، جيڪا فارنسڪ سائنس جي ترقي جي ڪري ٿيو.[22] تازو، اينڊريو زيڊ فائر ۽ ڪريگ سي ميلو کي جين ۾ آر اين اي مداخلت (RNAi) جي ڪردار کي دريافت ڪرڻ تي سال 2006ع جو نوبل انعام مليو.[23]
شروعاتي مواد: زندگي جا ڪيميائي عنصر
[سنواريو]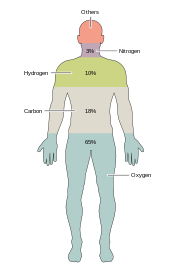
- اصل مضمون/مضمونن جي لاءِ ڏسو انساني جسم جي جوڙجڪ ۽ غذائي معدنيات
اٽڪل ٻه درجن ڪيميائي عنصر مختلف قسم جي حياتياتي زندگيءَ لاءِ ضروري آهن. ڌرتيءَ تي اڪثر ناياب عنصرن جي زندگيءَ جي ضرورت نه هوندي آهي (استثناءَ سيلينيم ۽ آئوڊين جا آهن)[24] جڏهن ته ڪجھ عام (ايلومينيم ۽ ٽائيٽينيم) استعمال نه ٿيندا آهن. اڪثر جاندار عناصر جي ضرورتن کي حصيداري ڪندا آهن، پر ٻوٽن ۽ جانورن جي وچ ۾ ڪجھ فرق آهن. مثال طور، سامونڊي الجي برومين استعمال ڪندا آهن، پر زميني ٻوٽن ۽ جانورن کي ڪا ضرورت محسوس نه ٿيندي آهي. سڀني جانورن کي سوڊيم جي ضرورت آهي، پر ٻوٽن لاءِ ضروري عنصر نه آهي. ٻوٽن کي بورون ۽ سلڪون جي ضرورت هوندي آهي، پر جانور شايد نه هجن (يا شايد ضرورت هجي ته ننڍي مقدار ۾).
صرف ڇهه عنصر؛ ڪاربن، هائيڊروجن، نائٽروجن، آڪسيجن، ڪيلشيم ۽ فاسفورس، جاندار جيو گھرڙن جي مجموعي جو لڳ ڀڳ 99 سيڪڙو حصو ٺاهين ٿا، جن ۾ انساني جسم ۾ موجود جزا شامل آهن (مڪمل فهرست لاءِ انساني جسم جي جوڙجڪ ڏسو). ڇهن وڏن عناصرن کان علاوه جيڪي انساني جسم جو اڪثر حصو ٺاهيندا آهن، انسان کي ننڍي مقدار ۾ ممڪن طور تي 18 وڌيڪ عناصر جي ضرورت هوندي آهي.[25]
حياتياتي ماليڪيول
[سنواريو]- اصل مضمون جي لاءِ ڏسو حياتياتي موليڪيول
حياتياتي ڪيميا ۾ ماليڪيولن جا 4 مکيه طبقا (جنهن کي اڪثر ڪري حياتياتي ماليڪيول سڏجن ٿا) ڪاربوهائيڊريٽ، ليپڊ (Lipids)، پروٽين ۽ نيوڪليڪ ايسڊ آهن.[26] ڪيترائي حياتياتي ماليڪيول پوليمر آهن: هن اصطلاح ۾، مونومرز (monomers) نسبتا ننڍا ميڪروموليڪيول (macromolecules) آهن جيڪي پوليمر جي نالي سان سڃاتل، وڏي ميڪرو ماليڪيول ٺاهڻ لاءِ پاڻ ۾ ڳنڍيل هوندا آهن. جڏهن مونومر هڪ حياتياتي پوليمر کي گڏ ڪرڻ لاء هڪ ٻئي سان ڳنڍيل هوندا آهن، اهي هڪ عمل مان گذريندا آهن جنهن کي ڊي هائيڊريشن سنٿيسس سڏيو ويندو آهي. مختلف ميڪرو ماليڪيول، اڪثر ڪري حياتياتي سرگرمي لاء گهربل وڏن ڪمپليڪس ۾ گڏ ٿي سگھن ٿا.
ڪاربوهائيڊريٽ
[سنواريو]Two
ڪاربوهائيڊريٽ توانائي جو ذريعو آهي: ڪاربوهائيڊريٽ ميٽابولزم ۽ ڪاربن چڪر. گلوڪوز اڪثر زندگي جي شڪلن ۾ هڪ توانائي جو ذريعو آهي. مثال طور، پوليسڪچرائڊز انزائمز ذريعي انهن جي مونومر ۾ ورهايل آهن (گلائڪوجن فاسفوريليز گلوڪوجن مان گلوڪوز جي باقيات کي هٽائي ٿو، هڪ پوليسڪچرائڊ). Disaccharides جهڙوڪ lactose يا sucrose انهن جي ٻن جزو monosaccharides ۾ ورهايل آهن. گلائڪولوسس (anaerobic): Glycolysis خلاصو. گلوڪوز بنيادي طور تي هڪ انتهائي اهم ڏهن قدمن واري رستي ذريعي ميٽابولائز ڪيو ويندو آهي جنهن کي گلائڪوليسس سڏيو ويندو آهي، جنهن جو خالص نتيجو اهو آهي ته گلوڪوز جي هڪ انو کي ٽوڙڻ لاء پيروويٽ جي ٻن ماليڪيولن ۾. اهو پڻ ATP جا خالص ٻه ماليڪيول پيدا ڪري ٿو، سيلز جي توانائي جي ڪرنسي، ان سان گڏ NAD+ (nicotinamide adenine dinucleotide: oxidized form) کي NADH (nicotinamide adenine dinucleotide: reduced form) ۾ تبديل ڪرڻ جا ٻه گھٽائيندڙ برابر. هن آڪسيجن جي ضرورت نه رکندو آھي; جيڪڏهن آڪسيجن موجود ناهي (يا سيل آڪسيجن استعمال نٿو ڪري سگهي)، NAD کي بحال ڪيو وڃي ٿو پائروويٽ کي ليڪٽيٽ (ليڪٽڪ ايسڊ) ۾ تبديل ڪري (مثال طور انسانن ۾) يا ايٿانول پلس ڪاربان ڊاءِ آڪسائيڊ (مثال طور خمير ۾). ٻيون monosaccharides جهڙوڪ galactose ۽ fructose کي گلائڪولائيٽڪ رستي جي وچ ۾ تبديل ڪري سگھجي ٿو.[40] ايروبڪ سنواريو ڪافي آڪسيجن سان ايروبڪ سيلز ۾، جيئن اڪثر انساني خاني ۾، پيروويٽ وڌيڪ ميٽابولائز ڪيو ويندو آهي. اهو ناقابل واپسي طور تي acetyl-CoA ۾ تبديل ڪيو ويو آهي، هڪ ڪاربن ايٽم کي فضول پيداوار ڪاربن ڊاء آڪسائيڊ جي طور تي ڏئي ٿو، هڪ ٻيو گهٽجڻ جي برابر NADH پيدا ڪري ٿو. ٻه ماليڪيول Acetyl-CoA (گلوڪوز جي هڪ ماليڪيول مان) پوءِ سائٽرڪ ايسڊ چڪر ۾ داخل ٿين ٿا، ATP جا ٻه ماليڪيول، ڇهه وڌيڪ NADH ماليڪيولز ۽ ٻه گھٽيل (ubi) quinones (FADH2 ذريعي اينزيم پابند ڪوفيڪٽر جي ذريعي) پيدا ڪن ٿا. باقي ڪاربان جوهر ڪاربان ڊاءِ آڪسائيڊ طور. پيدا ٿيل NADH ۽ quinol ماليڪيول وري تنفس جي زنجير جي اينزائم ڪمپليڪس ۾ کارائيندا آهن.
of the main functions of carbohydrates are energy storage and providing structure. One of the common sugars known as glucose is a carbohydrate, but not all carbohydrates are sugars. There are more carbohydrates on Earth than any other known type of biomolecule; they are used to store energy and genetic information, as well as play important roles in cell to cell interactions and communications.[حوالو گهربل]
The simplest type of carbohydrate is a monosaccharide, which among other properties contains carbon, hydrogen, and oxygen, mostly in a ratio of 1:2:1 (generalized formula CnH2nOn, where n is at least 3). Glucose (C6H12O6) is one of the most important carbohydrates; others include fructose (C6H12O6), the sugar commonly associated with the sweet taste of fruits,[27][lower-alpha 1] and deoxyribose (C5H10O4), a component of DNA. A monosaccharide can switch between acyclic (open-chain) form and a cyclic form. The open-chain form can be turned into a ring of carbon atoms bridged by an oxygen atom created from the carbonyl group of one end and the hydroxyl group of another. The cyclic molecule has a hemiacetal or hemiketal group, depending on whether the linear form was an aldose or a ketose.[29]
In these cyclic forms, the ring usually has 5 or 6 atoms. These forms are called furanoses and pyranoses, respectively—by analogy with furan and pyran, the simplest compounds with the same carbon-oxygen ring (although they lack the carbon-carbon double bonds of these two molecules). For example, the aldohexose glucose may form a hemiacetal linkage between the hydroxyl on carbon 1 and the oxygen on carbon 4, yielding a molecule with a 5-membered ring, called glucofuranose. The same reaction can take place between carbons 1 and 5 to form a molecule with a 6-membered ring, called glucopyranose. Cyclic forms with a 7-atom ring called heptoses are rare.[حوالو گهربل]
Two monosaccharides can be joined by a glycosidic or ester bond into a disaccharide through a dehydration reaction during which a molecule of water is released. The reverse reaction in which the glycosidic bond of a disaccharide is broken into two monosaccharides is termed hydrolysis. The best-known disaccharide is sucrose or ordinary sugar, which consists of a glucose molecule and a fructose molecule joined. Another important disaccharide is lactose found in milk, consisting of a glucose molecule and a galactose molecule. Lactose may be hydrolysed by lactase, and deficiency in this enzyme results in lactose intolerance.
When a few (around three to six) monosaccharides are joined, it is called an oligosaccharide (oligo- meaning "few"). These molecules tend to be used as markers and signals, as well as having some other uses.[30] Many monosaccharides joined form a polysaccharide. They can be joined in one long linear chain, or they may be branched. Two of the most common polysaccharides are cellulose and glycogen, both consisting of repeating glucose monomers. Cellulose is an important structural component of plant's cell walls and glycogen is used as a form of energy storage in animals.
Sugar can be characterized by having reducing or non-reducing ends. A reducing end of a carbohydrate is a carbon atom that can be in equilibrium with the open-chain aldehyde (aldose) or keto form (ketose). If the joining of monomers takes place at such a carbon atom, the free hydroxy group of the pyranose or furanose form is exchanged with an OH-side-chain of another sugar, yielding a full acetal. This prevents opening of the chain to the aldehyde or keto form and renders the modified residue non-reducing. Lactose contains a reducing end at its glucose moiety, whereas the galactose moiety forms a full acetal with the C4-OH group of glucose. Saccharose does not have a reducing end because of full acetal formation between the aldehyde carbon of glucose (C1) and the keto carbon of fructose (C2).
Lipids
[سنواريو]
Lipids comprise a diverse range of molecules and to some extent is a catchall for relatively water-insoluble or nonpolar compounds of biological origin, including waxes, fatty acids, fatty-acid derived phospholipids, sphingolipids, glycolipids, and terpenoids (e.g., retinoids and steroids). Some lipids are linear, open-chain aliphatic molecules, while others have ring structures. Some are aromatic (with a cyclic [ring] and planar [flat] structure) while others are not. Some are flexible, while others are rigid.[33]
Lipids are usually made from one molecule of glycerol combined with other molecules. In triglycerides, the main group of bulk lipids, there is one molecule of glycerol and three fatty acids. Fatty acids are considered the monomer in that case, and maybe saturated (no double bonds in the carbon chain) or unsaturated (one or more double bonds in the carbon chain).[حوالو گهربل]
Most lipids have some polar character and are largely nonpolar. In general, the bulk of their structure is nonpolar or hydrophobic ("water-fearing"), meaning that it does not interact well with polar solvents like water. Another part of their structure is polar or hydrophilic ("water-loving") and will tend to associate with polar solvents like water. This makes them amphiphilic molecules (having both hydrophobic and hydrophilic portions). In the case of cholesterol, the polar group is a mere –OH (hydroxyl or alcohol). [حوالو گهربل]
In the case of phospholipids, the polar groups are considerably larger and more polar, as described below.
Lipids are an integral part of our daily diet. Most oils and milk products that we use for cooking and eating like butter, cheese, ghee etc. are composed of fats. Vegetable oils are rich in various polyunsaturated fatty acids (PUFA). Lipid-containing foods undergo digestion within the body and are broken into fatty acids and glycerol, the final degradation products of fats and lipids. Lipids, especially phospholipids, are also used in various pharmaceutical products, either as co-solubilizers (e.g. in parenteral infusions) or else as drug carrier components (e.g. in a liposome or transfersome).
Proteins
[سنواريو]- اصل مضمون/مضمونن جي لاءِ ڏسو Protein ۽ Amino acid

Proteins are very large molecules—macro-biopolymers—made from monomers called amino acids. An amino acid consists of an alpha carbon atom attached to an amino group, –NH2, a carboxylic acid group, –COOH (although these exist as –NH3+ and –COO− under physiologic conditions), a simple hydrogen atom, and a side chain commonly denoted as "–R". The side chain "R" is different for each amino acid of which there are 20 standard ones. It is this "R" group that makes each amino acid different, and the properties of the side chains greatly influence the overall three-dimensional conformation of a protein. Some amino acids have functions by themselves or in a modified form; for instance, glutamate functions as an important neurotransmitter. Amino acids can be joined via a peptide bond. In this dehydration synthesis, a water molecule is removed and the peptide bond connects the nitrogen of one amino acid's amino group to the carbon of the other's carboxylic acid group. The resulting molecule is called a dipeptide, and short stretches of amino acids (usually, fewer than thirty) are called peptides or polypeptides. Longer stretches merit the title proteins. As an example, the important blood serum protein albumin contains 585 amino acid residues.[34]


Proteins can have structural and/or functional roles. For instance, movements of the proteins actin and myosin ultimately are responsible for the contraction of skeletal muscle. One property many proteins have is that they specifically bind to a certain molecule or class of molecules—they may be extremely selective in what they bind. Antibodies are an example of proteins that attach to one specific type of molecule. Antibodies are composed of heavy and light chains. Two heavy chains would be linked to two light chains through disulfide linkages between their amino acids. Antibodies are specific through variation based on differences in the N-terminal domain.[35]
The enzyme-linked immunosorbent assay (ELISA), which uses antibodies, is one of the most sensitive tests modern medicine uses to detect various biomolecules. Probably the most important proteins, however, are the enzymes. Virtually every reaction in a living cell requires an enzyme to lower the activation energy of the reaction. These molecules recognize specific reactant molecules called substrates; they then catalyze the reaction between them. By lowering the activation energy, the enzyme speeds up that reaction by a rate of 1011 or more; a reaction that would normally take over 3,000 years to complete spontaneously might take less than a second with an enzyme. The enzyme itself is not used up in the process and is free to catalyze the same reaction with a new set of substrates. Using various modifiers, the activity of the enzyme can be regulated, enabling control of the biochemistry of the cell as a whole.
The structure of proteins is traditionally described in a hierarchy of four levels. The primary structure of a protein consists of its linear sequence of amino acids; for instance, "alanine-glycine-tryptophan-serine-glutamate-asparagine-glycine-lysine-...". Secondary structure is concerned with local morphology (morphology being the study of structure). Some combinations of amino acids will tend to curl up in a coil called an α-helix or into a sheet called a β-sheet; some α-helixes can be seen in the hemoglobin schematic above. Tertiary structure is the entire three-dimensional shape of the protein. This shape is determined by the sequence of amino acids. In fact, a single change can change the entire structure. The alpha chain of hemoglobin contains 146 amino acid residues; substitution of the glutamate residue at position 6 with a valine residue changes the behavior of hemoglobin so much that it results in sickle-cell disease. Finally, quaternary structure is concerned with the structure of a protein with multiple peptide subunits, like hemoglobin with its four subunits. Not all proteins have more than one subunit.[36]


Ingested proteins are usually broken up into single amino acids or dipeptides in the small intestine and then absorbed. They can then be joined to form new proteins. Intermediate products of glycolysis, the citric acid cycle, and the pentose phosphate pathway can be used to form all twenty amino acids, and most bacteria and plants possess all the necessary enzymes to synthesize them. Humans and other mammals, however, can synthesize only half of them. They cannot synthesize isoleucine, leucine, lysine, methionine, phenylalanine, threonine, tryptophan, and valine. Because they must be ingested, these are the essential amino acids. Mammals do possess the enzymes to synthesize alanine, asparagine, aspartate, cysteine, glutamate, glutamine, glycine, proline, serine, and tyrosine, the nonessential amino acids. While they can synthesize arginine and histidine, they cannot produce it in sufficient amounts for young, growing animals, and so these are often considered essential amino acids.
If the amino group is removed from an amino acid, it leaves behind a carbon skeleton called an α-keto acid. Enzymes called transaminases can easily transfer the amino group from one amino acid (making it an α-keto acid) to another α-keto acid (making it an amino acid). This is important in the biosynthesis of amino acids, as for many of the pathways, intermediates from other biochemical pathways are converted to the α-keto acid skeleton, and then an amino group is added, often via transamination. The amino acids may then be linked together to form a protein.
A similar process is used to break down proteins. It is first hydrolyzed into its component amino acids. Free ammonia (NH3), existing as the ammonium ion (NH4+) in blood, is toxic to life forms. A suitable method for excreting it must therefore exist. Different tactics have evolved in different animals, depending on the animals' needs. Unicellular organisms release the ammonia into the environment. Likewise, bony fish can release ammonia into the water where it is quickly diluted. In general, mammals convert ammonia into urea, via the urea cycle.
In order to determine whether two proteins are related, or in other words to decide whether they are homologous or not, scientists use sequence-comparison methods. Methods like sequence alignments and structural alignments are powerful tools that help scientists identify homologies between related molecules. The relevance of finding homologies among proteins goes beyond forming an evolutionary pattern of protein families. By finding how similar two protein sequences are, we acquire knowledge about their structure and therefore their function.
Nucleic acids
[سنواريو]
Nucleic acids, so-called because of their prevalence in cellular nuclei, is the generic name of the family of biopolymers. They are complex, high-molecular-weight biochemical macromolecules that can convey genetic information in all living cells and viruses.[37] The monomers are called nucleotides, and each consists of three components: a nitrogenous heterocyclic base (either a purine or a pyrimidine), a pentose sugar, and a phosphate group.[38]

The most common nucleic acids are deoxyribonucleic acid (DNA) and ribonucleic acid (RNA). The phosphate group and the sugar of each nucleotide bond with each other to form the backbone of the nucleic acid, while the sequence of nitrogenous bases stores the information. The most common nitrogenous bases are adenine, cytosine, guanine, thymine, and uracil. The nitrogenous bases of each strand of a nucleic acid will form hydrogen bonds with certain other nitrogenous bases in a complementary strand of nucleic acid. Adenine binds with thymine and uracil, thymine binds only with adenine, and cytosine and guanine can bind only with one another. Adenine, thymine, and uracil contain two hydrogen bonds, while hydrogen bonds formed between cytosine and guanine are three.
Aside from the genetic material of the cell, nucleic acids often play a role as second messengers, as well as forming the base molecule for adenosine triphosphate (ATP), the primary energy-carrier molecule found in all living organisms. Also, the nitrogenous bases possible in the two nucleic acids are different: adenine, cytosine, and guanine occur in both RNA and DNA, while thymine occurs only in DNA and uracil occurs in RNA.
ميٽابولزم
[سنواريو]ڪاربوهائيڊريٽ بطور توانائي جو ذريعو
[سنواريو]- اصل مضمون/مضمونن جي لاءِ ڏسو ڪاربوهائيڊريٽ ميٽابولزم ۽ ڪاربن چڪر
گلوڪوز اڪثر زندگي جي شڪلن ۾ هڪ توانائي جو ذريعو آهي. مثال طور، پولي سيڪارائڊ خامرن (Enzymes) جي ذريعي انهن جي مونومر (گلائڪوجن فاسفوريليز گلوڪوجن مان گلوڪوز جي باقيات کي هٽائي ٿو، هڪ پولي سيڪارائڊ) ۾ ورهايل آهن. ڊاء سيڪارائڊ جهڙوڪ ليڪتوس (Lactose) يا سڪروز (Sucrose) انهن جي ٻن جزو مونوسيڪارائڊ ۾ ورهايل آهن.[39]
گلائڪوليسس (anaerobic)
[سنواريو]گلوڪوز بنيادي طور تي هڪ انتهائي اهم ڏهن قدمن واري رستي ذريعي ميٽابولائز ڪيو ويندو آهي جنهن کي گلائڪو ليسس سڏيو ويندو آهي، جنهن جو خالص نتيجو، گلوڪوز جي هڪ ماليڪيول کي ٽوڙڻ لاء پيروويٽ جي ٻن ماليڪيولن ۾ تبديل ڪرڻ آھي. اهو پڻ ATP جا خالص ٻه ماليڪيول، جيو گھرڙن جي توانائي جي ڪرنسي، ان سان گڏ، ٻه گھٽائيندڙ برابر، جيڪا NAD+ (نڪوٽينامائڊ اڊينائن ڊاء نيوڪليوٽائيڊ: آڪسيڊائزڊ شڪل) کي NADH (نڪوٽينامائڊ اڊينائن ڊاء نيوڪليوٽائيڊ: ريڊيوسڊ شڪل) ۾ تبديل ڪرڻ ٿا، پيدا ڪري ٿو. هن کي آڪسيجن جي ضرورت نه آھي؛ جيڪڏهن آڪسيجن موجود ناهي (يا جيو گھرڙو آڪسيجن استعمال نٿو ڪري سگهي)، NAD کي، پائروويٽ جي ليڪٽيٽ (ليڪٽڪ ايسڊ) ۾ تبديل ڪري، بحال ڪيو وڃي ٿو (مثال طور انسانن ۾) يا ايٿانول پلس ڪاربان ڊاءِ آڪسائيڊ (مثال طور خمير ۾). ٻيون مونوسيڪارائڊ جهڙوڪ گيليڪتوس (galactose) ۽ فرڪتوس کي گلائڪولائيٽڪ رستي جي وچ ۾ تبديل ڪري سگھجي ٿو.[40]
ايروبڪ گلائڪوليسس
[سنواريو]ايروبڪ گلائڪوليسس ۾ جيو گھرڙا ڪافي آڪسيجن سان، جيئن اڪثر انساني جيو گھرڙن ۾، پيروويٽ وڌيڪ ميٽابولائز ڪيو ويندو آهي. اهو ناقابل واپسي طور تي acetyl-CoA ۾ تبديل ڪيو ويو آهي، هڪ ڪاربن ايٽم کي فاضل پيداوار ڪاربن ڊاء آڪسائيڊ جي طور تي ڏئي ٿو، هڪ ٻيو گهٽجڻ جي برابر NADH پيدا ڪري ٿو. ٻه ماليڪيول ايسيتائل-CoA (گلوڪوز جي هڪ ماليڪيول مان) پوءِ سائٽرڪ ايسڊ چڪر ۾ داخل ٿين ٿا، ATP جا ٻه ماليڪيول، ڇهه وڌيڪ NADH ماليڪيولز ۽ ٻه گھٽيل (ubi) ڪوينون (quinones) (FADH2 ذريعي اينزيم پابند ڪوفيڪٽر جي ذريعي) پيدا ڪن ٿا. باقي ڪاربن ايٽم ڪاربن ڊاءِ آڪسائيڊ طور خارج ٿي ويندا آهن. پيدا ٿيل NADH ۽ ڪوينول (quinol) ماليڪيول وري تنفس جي زنجير جي اينزائم ڪمپليڪس ۾ کارائيندا آهن، هڪ اليڪٽران ٽرانسپورٽ سسٽم اليڪٽرانن کي آخرڪار آڪسيجن ڏانهن منتقل ڪري ٿو ۽ جاري ڪيل توانائي کي پروٽون گرڊيئينٽ جي صورت ۾ هڪ جھلي مٿان (اندروني مائيٽوڪونڊريل جھلي يوڪريوٽن ۾) محفوظ ڪري ٿو. اهڙيءَ طرح، آڪسيجن پاڻيءَ ۾ گھٽجي ويندي آهي ۽ اصل اليڪٽران قبول ڪندڙ NAD+ ۽ ڪوئنون ٻيهر ٺاهيا ويندا آهن. اهو ئي سبب آهي جو انسان ساهه ۾ آڪسيجن اندر کڻندو آهي ۽ ڪاربن ڊاءِ آڪسائيڊ ٻاهر ڪڍي ٿو. اين ائ ڊي ايخ NADH ۽ ڪوينول ۾ اعلي توانائي واري حالتن مان اليڪٽرانن کي منتقل ڪرڻ کان جاري ڪيل توانائي پهريون ڀيرو پروٽون گريڊئنيٽ طور محفوظ ڪئي وڃي ٿي ۽ اي ٽي پي سنٿيسس ذريعي اي ٽي پي ۾ تبديل ٿئي ٿي. هي اي ٽي پي جا اضافي 28 ماليڪيول ٺاهي ٿو (24 8 NADH کان ۽ 4 2 ڪوينول کان)، مجموعي طور تي، في گريڊئنيٽ گلوڪوز (ٻه گلائڪوليسس کان + ٻه سائٽريٽ چڪر مان) کان، اي ٽي پي جا 32 ماليڪيول محفوظ ڪيا ويا.[41] واضح رهي ته گلوڪوز کي مڪمل طور تي آڪسيدائيزڊ ڪرڻ لاءِ آڪسيجن جو استعمال، ڪنهن به عضوي کي آڪسيجن کان آزاد ميٽابولڪ خصوصيت کان تمام گهڻي توانائي فراهم ڪري ٿو ۽ اهو ئي سبب سمجهيو وڃي ٿو ته پيچيده زندگي ڌرتيءَ جي فضا ۾ آڪسيجن جي وڏي مقدار جمع ٿيڻ کان پوءِ ئي ظاهر ٿي.
گلوڪونيوجنيسس
[سنواريو]- اصل مضمون جي لاءِ ڏسو گلوڪونيوجنيسس
فقاريه جانورن (vertebrates) ۾، سختيءَ سان سڪڙجڻ وارا مسل کي ٺيڪ ڪرڻ (مثال طور وزن کڻڻ يا ڊوڙڻ دوران) توانائي جي گهرج کي پورو ڪرڻ لاءِ ڪافي آڪسيجن حاصل نه ڪندا آهن ۽ ان ڪري اهي اين ايروبڪ ميٽابولزم ڏانهن ويندا آهن ۽ گلوڪوز کي ليڪٽيٽ ۾ تبديل ڪندا آهن. اها نان ڪاربوهائيڊريٽ، جهڙوڪ چربی ۽ پروٽين مان گلوڪوز جو ميلاپ آهي. اهو صرف تڏهن ٿئي ٿو جڏهن جگر ۾ گلائڪوجن جي فراهمي ختم ٿي ويندي آهي. اهو رستو گلائيڪوليسس جو هڪ اهم ردوبدل آهي پائروويٽ کان گلوڪوز تائين ۽ ڪيترن ئي ذريعن کي استعمال ڪري سگهي ٿو جهڙوڪ امينو ايسڊ، گليسرول ۽ ڪربس سائيڪل. وڏي پيماني تي پروٽين ۽ چربی جي توڙ (catabolism) عام طور تي تڏهي ٿئي ٿي جڏهن ڪنهن بکيو يا ڪجهه اينڊوڪرائن (endocrine) [42] مشڪلاتن جو شڪار ٿئي ٿو. جگر گلوڪوز کي، هڪ عمل کي استعمال ڪندي جنهن کي گلوڪونيوجنيسس سڏيو ويندو آهي، ٻيهر پيدا ڪري ٿو. اهو عمل گليڪوليسس جي بلڪل مخالف نه آهي، ۽ اصل ۾ گليڪوليسس جي مقابلي ۾ ٽي ڀيرا توانائي جي مقدار جي ضرورت پوندي آهي (اي ٽي پي جا ڇهه ماليڪيول استعمال ڪيا ويا آهن، گلائيڪوليسس ۾ حاصل ڪيل ٻن جي مقابلي ۾). مٿي ڏنل رد عملن جي برابر، پيدا ٿيل گلوڪوز وري ٽشوز ۾ گلائڪوليزيشن (Glycolysis) مان گذري سگھي ٿي جن کي توانائي جي ضرورت آهي، گلائڪوجن (يا ٻوٽن ۾ نشاستي) جي طور تي ذخيرو ڪيو وڃي ٿو، يا ٻين مونوساڪريڊس ۾ تبديل ڪيو وڃي ٿو يا ڊائي- يا اوليگوساڪرائڊس ۾ شامل ٿي سگھي ٿو. ورزش دوران گلائڪوليسس جا گڏيل رستا، رت جي وهڪري ذريعي جگر تائين ليڪٽيٽ جو گذرڻ ۽ گلوڪونيوجينيسس ۽ گلوڪوز کي رت جي وهڪري ۾ ڇڏڻ کي "ڪوري چڪر" چئبو آهي.[43]
ٻين "موليڪيولر-اسڪيل" جي حياتياتي سائنسن سان تعلق
[سنواريو]
حياتياتي ڪيميا ۾ محقق، بائيو ڪيمسٽري جي مخصوص ٽيڪنيڪون استعمال ڪن ٿا، پر انهن کي جينيات، ماليڪيولر حياتيات ۽ حياتياتي طبيعيات جي شعبن ۾ ترقي يافته ٽئڪنالاجي ۽ خيالن سان گڏ وڌندا آهن. انهن نظمن جي وچ ۾ ڪو به واضح لڪير نه آهي. بايو ڪيمسٽري ان ڪيمسٽري جو مطالعو ڪري ٿي جيڪا ماليڪيولن جي حياتياتي سرگرمي لاءِ گهربل هجي، ماليڪيولر بائلاجي انهن جي حياتياتي سرگرمي جو مطالعو ڪري ٿي، جينيات انهن جي موروثيت جو مطالعو ڪري ٿي، جيڪو انهن جي جينوم ذريعي ٿئي ٿو. اھو ھيٺ ڏنل اسڪيمياتي ۾ ڏيکاريو ويو آھي جيڪو ھڪڙي ممڪن نظر شعبن جي وچ ۾ لاڳاپن کي ڏيکاري ٿو.
- بايو ڪيمسٽري ڪيميائي مادن ۽ جاندارن ۾ ٿيندڙ اهم عملن جو مطالعو آهي. بايو ڪيمسٽ بائيو ماليڪيولز جي ڪردار، ڪم ۽ ڍانچي تي تمام گهڻو ڌيان ڏيندا آهن. حياتياتي عملن جي پويان ڪيميا جو مطالعو ۽ حياتياتي طور تي فعال ماليڪيولن جي ٺهڻ بائيو ڪيمسٽري جون ايپليڪيشنون آهن. حياتيات جو اڀياس ائٽمي ۽ ماليڪيولر سطح تي زندگيءَ جو اڀياس آهي.
- جينيات جاندارن ۾ جينياتي فرق جي اثر جو مطالعو آهي. اهو عام طور تي عام جزو جي غير موجودگيءَ (مثال طور هڪ جين) جو اندازو لڳائي سگهجي ٿو. "ميوٽنٽ" جو مطالعو، اهي جاندار جيڪي هڪ يا وڌيڪ ڪم ڪندڙ جزن، "جهنگلي قسم" يا عام فينوٽائپ جي حوالي سان، جي کوٽ نه آهن. جينياتي تعاملات (ايپيسٽاسس) اڪثر ڪري اهڙين "ناڪ آئوٽ" مطالعي جي سادي تشريح کي غلط ثابت ڪري سگهي ٿي.
- ماليڪيولر حياتيات (Molecular Biology) حياتياتي رجحان جي ماليڪيولر انڊرپننگز جو مطالعو آهي، جيڪو ماليڪيولن جي سنٿيسس، ترميم، ميڪانيزم ۽ تعامل تي ڌيان ڏئي ٿي. ماليڪيولر بائلاجي جو مرڪزي ڪتو، جتي جينياتي مواد کي آر اين اي (RNA) ۾ نقل ڪيو ويندو آهي ۽ پوءِ پروٽين ۾ ترجمو ڪيو ويندو آهي، ان کان وڌيڪ آسان هجڻ جي باوجود، اڃا به فيلڊ کي سمجهڻ لاءِ سٺو شروعاتي نقطو مهيا ڪري ٿو. آر اين اي لاءِ اڀرندڙ نئين ڪردارن جي روشنيءَ ۾ هن تصور تي نظرثاني ڪئي وئي آهي.
- ڪيميائي حياتيات ننڍڙن ماليڪيولن جي بنياد تي نوان اوزار تيار ڪرڻ جي ڪوشش ڪري ٿي جيڪي حياتياتي نظام کي گھٽ ۾ گھٽ خرابي جي اجازت ڏين ٿا جڏهن ته انهن جي ڪم بابت تفصيلي ڄاڻ مهيا ڪري ٿي. وڌيڪ، ڪيميائي حياتيات، غير فطري هائبرڊز ٺاهڻ لاءِ حياتياتي ماليڪيولز ۽ مصنوعي ڊوائيسز جي وچ ۾ (مثال طور خالي ٿيل وائرل ڪيپسڊ جيڪي جين ٿراپي (Gene Therapy) يا دوا جي ماليڪيولن کي پهچائڻ لاء استعمال ٿين ٿا)، لاء حياتياتي نظامن کي استعمال ڪري ٿي.
پڻ ڏسو
[سنواريو]- حياتياتي انجنيئرنگ
- حياتياتي ماليڪيولن جي فهرست
- اي سي نمبر
- بايو ڪيمسٽري ۽ ماليڪيولر بيالوجي جي بين الاقوامي يونين
- ميٽابولزم
- TCA چڪر
ٻاھريان ڳنڍڻا
[سنواريو]| لائبريري وسيلا بابت حياتياتي ڪيميا |
| Wikibooks has more on the topic of |
| وڪيميڊيا العام ۾ حياتياتي ڪيميا سان لاڳاپيل ابلاغي مواد ڏسو. |
- "Biochemical Society".
- The Virtual Library of Biochemistry, Molecular Biology and Cell Biology
- Biochemistry, 5th ed. Full text of Berg, Tymoczko, and Stryer, courtesy of NCBI.
- SystemsX.ch – The Swiss Initiative in Systems Biology
- Full text of Biochemistry by Kevin and Indira, an introductory biochemistry textbook.
حوالا
[سنواريو]- ↑ Ziesak (1999), p. 169.
- ↑ Kleinkauf (1988), p. 116.
- ↑ Ben-Menahem (2009), p. 2982.
- ↑ Amsler (1986), p. 55.
- ↑ Horton (2013), p. 36.
- ↑ Kleinkauf (1988), p. 43.
- ↑ Helvoort (2000), p. 81.
- ↑ Hunter (2000), p. 75.
- ↑ Hamblin (2005), p. 26.
- ↑ Hunter (2000), pp. 96–98.
- ↑ Helvoort (2000), p. 81.
- ↑ Berg (1980), pp. 1–2.
- ↑ Holmes (1987), p. xv.
- ↑ Feldman (2001), p. 206.
- ↑ Rayner-Canham (2005), p. 136.
- ↑ Fiske (1890), pp. 419–20.
- ↑ Wöhler, F. (1828). "Ueber künstliche Bildung des Harnstoffs". Annalen der Physik und Chemie 88 (2): 253–256. doi:. ISSN 0003-3804. Bibcode: 1828AnP....88..253W. http://dx.doi.org/10.1002/andp.18280880206. Retrieved 2021-05-04.
- ↑ Kauffman (2001), pp. 121–133.
- ↑ Lipman, Timothy O. (August 1964). "Wohler's preparation of urea and the fate of vitalism". Journal of Chemical Education 41 (8): 452. doi:. ISSN 0021-9584. Bibcode: 1964JChEd..41..452L. http://dx.doi.org/10.1021/ed041p452. Retrieved 2021-05-04.
- ↑ Tropp (2012), pp. 19–20.
- ↑ Krebs (2012), p. 32.
- ↑ Butler (2009), p. 5.
- ↑ Chandan (2007), pp. 193–194.
- ↑ Cox, Nelson, Lehninger (2008). Lehninger Principles of Biochemistry. Macmillan.
- ↑ Nielsen (1999), pp. 283–303.
- ↑ Slabaugh (2007), pp. 3–6.
- ↑ Whiting (1970), pp. 1–31.
- ↑ Whiting, G.C. (1970), p. 5.
- ↑ Voet (2005), pp. 358–359.
- ↑ Varki (1999), p. 17.
- ↑ Stryer (2007), p. 328.
- ↑ Voet (2005), Ch. 12 Lipids and Membranes.
- ↑ Ahmed, Saba; Shah, Parini; Ahmed, Owais, "Biochemistry, Lipids", StatPearls (Treasure Island (FL): StatPearls Publishing), PMID 30247827 Check
|pmid=value (مدد), حاصل ڪيل 2023-11-30 - ↑ Metzler (2001), p. 58.
- ↑ Feige, Matthias J.; Hendershot, Linda M.; Buchner, Johannes (2010). "How antibodies fold". Trends in Biochemical Sciences 35 (4): 189–198. doi:. PMID 20022755.
- ↑ Fromm and Hargrove (2012), pp. 35–51.
- ↑ حوالي جي چڪ: Invalid
<ref>tag; no text was provided for refs namedVoet_2005 - ↑ Saenger (1984), p. 84.
- ↑ "Disaccharide". Encyclopedia Britannica. وقت 19 October 2023 تي اصل کان آرڪائيو ٿيل. حاصل ڪيل 14 October 2023. Unknown parameter
|url-status=ignored (مدد) - ↑ Fromm and Hargrove (2012), pp. 163–180.
- ↑ Voet (2005), Ch. 17 Glycolysis.
- ↑ A Dictionary of Biology. Oxford University Press. 17 September 2015. ISBN 9780198714378. https://www.oxfordreference.com/view/10.1093/acref/9780198714378.001.0001/acref-9780198714378. Retrieved 29 April 2020.
- ↑ Fromm and Hargrove (2012), pp. 183–194.
حوالي جي چڪ: "lower-alpha" نالي جي حوالن جي لاءِ ٽيگ <ref> آهن، پر لاڳاپيل ٽيگ <references group="lower-alpha"/> نہ مليو
- حوالن ۾ چُڪَ وارا صفحا
- حوالا ۾ غلطيون: پي ايم آءِ ڊي
- غيرمددي پيراميٽر سان حوالا تي مشتمل صفحا
- سانچا
- اڻ تصديق ٿيل دعوائن وارا مضمون
- اڻ تصديق ٿيل دعوائن وارا مضمون از April 2023
- اڻ تصديق ٿيل دعوائن وارا مضمون از March 2024
- LCCN سان سڃاڻپ ڪندڙ وڪيپيڊيا مضمون
- GND سان سڃاڻپ ڪندڙ وڪيپيڊيا مضمون
- Biochemistry
- Biotechnology
- Molecular biology
- Genomics
- ڪيميا
- حياتيات
- درسي علم
- زندگي جي سائنس
- علم ڪيميا جي شاخون



